
创伤,手术及先天性出血性疾病等引发的大出血时常需要输血治疗,然而与输血的益处相伴的风险也逐渐被充分的认识。输注血浆、血小板和红细胞会增加感染性疾病(如巨细胞病毒、乙肝病毒、丙肝病毒、艾滋病毒感染及细菌感染等)、ABO血型不相容、免疫抑制、输血性肺损伤等疾病的发病率[1-3]。科学合理地使用各种血液制品,对于提高输血的疗效与节约血源、减少不良输血反应、最大限度地降低输血传播性疾病的发生至关重要。
常规凝血试验,如APTT、PT、血小板计数等只反映凝血起始阶段少量凝血酶的形成,并不能提供血小板功能、血栓强度、纤溶活性等信息。而且,这些体外试验的温度、pH值、血小板水平与体内环境有所不同,不能真实反映体内的凝血状态。通常的血小板计数和纤维蛋白原检测只提供数值,并不能反映它们的功能状况。研究表明,PT、APTT检测结果和临床凝血功能障碍及出血相关性差,不能如实反映早期复苏的效果[4,5]。Counts等对接受大量输血治疗的患者的凝血功能进行了广泛前瞻性分析,指出只有当PT,APTT 和出血时间明显延长时才对治疗有指导意义[6]。Lucas等利用低血容量性休克动物模型进行复苏试验,研究发现当输注相当于15个单位的全血时PT和APTT才有改变[7]。
血栓弹力图(Thrombelastograghy,TEG)是一种完全不同于目前常规凝血试验的检测方法,它用微量全血检测血小板,凝血因子、纤维蛋白原、纤溶系统和其他细胞成分之间的相互作用。提供有关整个凝血过程的资料并能进行连续监测,准确的提供病人的凝血概况。如:是低凝、高凝,还是纤溶亢进。如果是低凝,还可进一步判断造成低凝的原因(凝血因子缺乏、低纤维蛋血原水平、低血小板活性或数量)。利用TEG来指导病人输血,可大大减少血制品的用量,综合分析TEG的各个参数,能解决成分输血治疗中的何时输、输什么、输多少的问题,为临床医生和血库人员指导和监测血制品的使用提供科学、客观可靠的依据[8-11]。在术中,TEG能快速简化凝血障碍的诊断,使医生有充分的自信对凝血异常进行有效地处理,防止凝血异常的进一步恶化和不可控制的大出血.因此TEG是一些复杂手术尤其是心血管和肝脏手术等最有效的凝血功能监测方法.
本文就TEG工作原理、临床应用及结果分析作一简要介绍并综述其在输血中的指导作用。
TEG的设计原理
TEG是由血栓弹性描记仪描记的凝血动态过程曲线,是一种能动态分析凝血形成和纤维蛋白溶解全过程的曲线图。TEG于1948年由Hartert发明[12],之后一直用于实验研究,直到20世纪80年代中后期才开始应用于临床,现已成为围手术期监测凝血功能的重要指标。并已广泛应用于肝移植、心脏外科、肾移植、创伤外科等诸多领域,指导围手术期的血液输注、各种药物的应用、诊断溶栓及抗凝治疗等。
TEG 能监测病人的凝血状况,凝血过程的最终结果是形成血凝块;血凝块的物理性质(形成速率、硬度及稳定性)将决定病人是否拥有正常的凝血功能,即是否会出血,或是否有血栓形成。设计原理(见图1)是将血液标本装载在不能被随意移动的样品杯内,杯体震荡旋转的周期为10秒钟,以4°45’的角度旋转。样品杯盖上的探针悬浮在血液标本中,。纤维蛋白原与血小板结合后,血液凝固使杯体与探针结合成一体,纤维蛋白、血小扳复合物的强度能影响探针运动的幅度, 以致较硬的血凝块能直接随着杯体的运动而移动探针。因此,探针的运动幅度直接与己形成的血凝块的强度有关。当血凝块回缩或溶解时,探针与血凝块的联结解除,杯的运动就不能再传递给探针了,其运动幅度减弱。探针的转动强度通过与杯盖连接的悬垂丝及机械电子传感器转换成电脑监控的电信号及图形,其输出强度与血凝块的强度相关,振幅值代表了任何时间的凝块强度,最大振幅(MA)代表了最大血凝块强度。随着血凝块收缩或降解,结合力破坏,振幅降低[13] 。
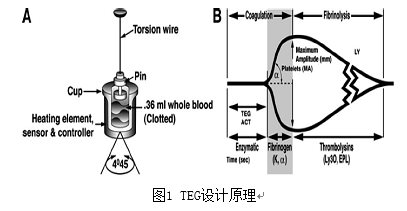
TEG主要技术参数
TEG能监测血凝块的结构组成、形成速率以及细胞、血浆成份相互作用。动态测量血凝块的发生发展变化过程,定量分析整个凝血状态及其降解情况。可通过图形信息测量血凝块形成及溶解的几个主要参数,见图2.测定参数如下:
R值:指血样置入TEG开始到第一块纤维蛋白凝块形成(描记图幅度达2mm)所需的时间, 反映参加凝血过程(内源性、外源性和共同途径)所有凝血因子的综合作用。R值能因抗凝剂及凝血因子缺乏而延长, 因血液呈高凝状态而缩短。
K值:从R时间终点至描记图幅度达20mm所需的时间,反映纤维蛋白和血小板在凝血块开始形成时的共同作用结果,即反映血凝块形成的速率。K值的长短受的纤维蛋白原水平高低的影响,而受到血小板功能的影响则较小。影响两者的抗凝剂可延长K值。
α角:纤维蛋白和血小板在凝血块开始形成时的共同作用结果。从血凝块形成点至描记图最大曲线弧度作切线与水平线的夹角,角与K值密切相关,都是反映血凝块聚合的速率。当凝血处于重度低凝状态时,血块幅度达不到20mm,此时K值无法确定。因此,α角比K值更有价值。影响α角的因素与K值相同。
MA:TEG图上的最大振幅,即最大切应力系数(mm)。反映正在形成的血凝块的最大强度及血凝块形成的稳定性。MA主要受纤维蛋白原及血小板两个因素的影响,其中血小板的作用(约占80%)要比纤维蛋白原(约占20%)大,血小板质量或数量的异常都会影响到MA值。
LY30:测量在MA值确定后30分钟内血凝分钟块消融 (或减少)的速率(%),反应MA后30分钟血液的纤溶活性。
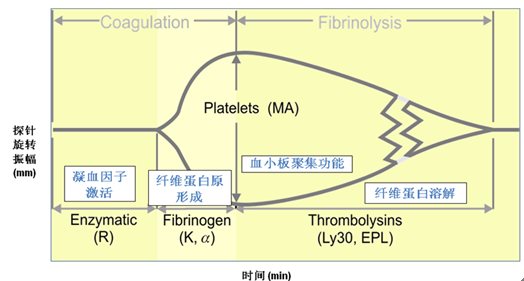
图2 TEG测量参数
TEG检测项目
TEG技术检测类型主要包括普通TEG、肝素酶对比检测、快速TEG和血小板图检测等。
普通TEG以高岭土作为激活剂,主要用于评估凝血全貌和判断凝血状态,指导成分输血,判断促凝和抗凝等药物的疗效及评估血栓发生几率,预防手术后的血栓发生。
TEG肝素酶对比检测可以评估肝素、低分子肝素以及类肝素药物疗效;评估是否肝素抵抗或过量,能在体外循环手术期间进行动态的凝血监测,提供凝血方面的早期信息,合理指导治疗。
快速TEG(RTEG)以组织因子(TF)为激活剂,能够加速凝血级联反应,以活化凝血时间(TEG ACT)取代普通TEG的反应时间(R)。普通TEG检测一般需要30分钟,而RTEG可以在19分钟内完成。TEG ACT的正常范围为0-118秒,是开始测试至纤维蛋白开始形成的时间,其它参数和普通TEG一致。ACT常被用于监测体外循环手术转流后的肝素化效应。由于能对凝血状态快速、实时、准确的进行评估,快速TEG在创伤后凝血病的诊断中应用价值较大。TEG软件能够实现远程监控,医师在患者床边就可监测曲线形成的全过程。
TEG血小板图监测抗血小板药物的疗效,检测病人血小板被血小板抗药物抑制的情况。血小板图检测利用4种诱导剂促进血液凝集:诱导剂高岭土激活血浆凝血酶的生成,凝血酶再激活血小板,形成凝血块。激活剂F不激活血小板而只将纤维蛋白原转化为纤维蛋白从而凝集,激活剂F联合ADP或AA一方面将纤维蛋白原转化为纤维蛋白,另一方面激活未被药物抑制的血小板,凝集成块。通过比较不同反应杯中血块凝集的最大粘弹性(MA)之比,来量化COX-1途径或ADP受体被药物抑制的情况,快速直接地为大出血、低凝或高凝状态的评估、抗凝治疗提供指导信息。
综上所述,通过TEG检测试剂中加入不同激活剂或抑制剂可以实现多种功能监测,从而提供更全面的凝血功能信息。
TEG和常规凝血测试方法的比较
Dougald M., Arterioscler Thromb Vasc Biol 2002, 22:1381-1389
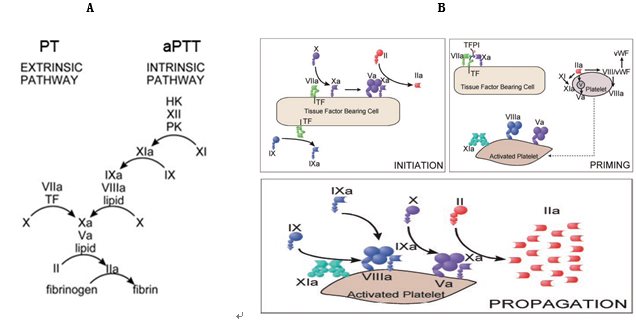
图3 凝血机制模式
A.级联反应凝血模式,将凝血分为内、外源途径和共同途径。PT检测参与外源途径的因子,APTT检测参与内源途径的因子。
B. 细胞学基础的凝血模式,此模式将凝血过程分为三个阶段,启动,放大和播散阶段。
传统的级联反应凝血模式学说(图3A)将凝血分为相对独立的内源性和外源性凝血途径,二者经过共同途径最终导致凝血酶的激活和纤维蛋白的形成。这个学说和常规凝血试验方法相吻合。PT检测外源性凝血因子,筛选纤维蛋白原、凝血酶原、和凝血因子Ⅴ、Ⅶ、Ⅹ的缺陷或抑制物的存在;APTT 检查内源性凝血因子,筛选凝血因子Ⅷ、Ⅸ、Ⅺ的缺陷以及凝血因子Ⅻ、激肽释放酶原和高分子量激肽释放酶原是否缺乏。级联反应凝血模式学说描述了参与凝血的多种蛋白之间的相互作用,但是忽略了血小板和血液中其它细胞成分在凝血过程中的重要作用,不足以反映体内凝血模式。
图3B描述了细胞学基础的凝血模式,此模式将凝血过程分为三个阶段,启动,放大和播散[14-19]。在启动阶段,TF承载细胞暴露于创伤表面,凝血因子Ⅶ(FVII)与TF结合而活化,TF/FVIIa复合物激活因子X和IX。活化的因子X在TF细胞表面激活因子V,活化的因子V和X启动少量凝血酶的产生[20]。放大阶段,少量凝血酶激活血小板并在血小板表面激活凝血因子V、 VIII和 XI[21,22]。在传播阶段,活化的因子IX结合到血小板表面和VIIIa形成IXa/VIIIa复合物,后者激活聚集到活化的血小板表面的因子X。活化的因子X和形成Xa/Va复合物激活产生大量的凝血酶(凝血酶爆发),诱导稳定的纤维蛋白凝块的产生。
细胞学基础的凝血模式学说阐述了血小板在凝血酶产生过程中的关键作用和完好的凝血酶对于形成坚固、稳定血凝块的重要性[23]。目前常规内外源凝血功能实验(如:PT, APTT)只能检测无血小板参与状态下的血浆中凝血因子活性。它不能阐明凝血全过程,只能反映凝血过程中某一阶段或某种凝血产物。在生理状态下血小板参与凝血反应,血小板与凝血因子的相互作用及其复杂,无血小板参与的凝血检测不能反应凝血全貌。血小板功能正常是凝血功能正常的必要条件,但单纯的血小板记数正常不能反应其功能是否正常。
TEG检测能够全面展现血凝块发生发展的全过程(图4),从各种凝血因子的激活到牢固的纤维蛋白链形成再到纤维蛋白溶解,展示患者凝血状况的全貌和血凝块形成的速率、血凝块的强度,血凝块的纤溶水平。TEG中的的MA和G值是估计血小板质和量并指导血小板输注的最好指标,能够很好地反应血小板的功能[24]。在过去的25年,20多个临床研究对TEG 和常规凝血试验指导输血的结果进行了评估。这些研究包括三个随机临床试验,涉及超过4500例接受大手术的患者。所有的报告表明与常规组相比,以TEG做指导治疗的患者对输血需求量减少,并且对输血量有很好的预测。下面就TEG指导创伤和心外科手术输血的实际案例做一分析,评估TEG在输血治疗中的临床应用价值。

图4 血液凝固过程vs常规凝血检测
TEG指导创伤病人合理输血
失血性休克导致的死亡率占创伤死亡率的50%,创伤后凝血病仍然是影响预后的主要因素。创伤发生后,首先凝血和纤溶系统都被激活,很快纤溶活性受抑制,血液呈高凝状态;随着失血、血液稀释、低体温状态和酸中毒的发展,凝血因子及血小板丢失和功能失调,血液进入低凝状态;纤溶系统再次被激活,进入纤溶亢进期。目前对于创伤后凝血紊乱还没有理想的输血方案,其中一个主要原因是常规凝血试验主要检测血浆中因子的异常,不能检测全血血凝块的粘弹性,后者对创伤后凝血紊乱的评估非常重要。在许多存在潜在的凝血功能障碍和持续性出血患者中,常规的凝血实验达不到监测目的。如前所述,TEG能实时对血凝块的形成进行粘弹性分析[25-29],参数R, K和α角与细胞凝血机制学说的启动,放大和播散三个阶段相吻合,较常规凝血实验具有更高的敏感性,可以检测到传统凝血实验不能检测的凝血异常。很多研究证实,TEG可以有效鉴别创伤后凝血系统的状态。急诊病人TEG检测的结果与创伤评分(ISS)和死亡率关系密切。中度外伤(ISS 10-20)TEG提示高凝状态;重度外伤(ISS 20-35)TEG提示低凝状态;大面积严重创伤(ISS>30)TEG提示纤溶亢进(图5)[30]。因此,TEG能够准确鉴别凝血状态,更好的指导临床输血治疗。
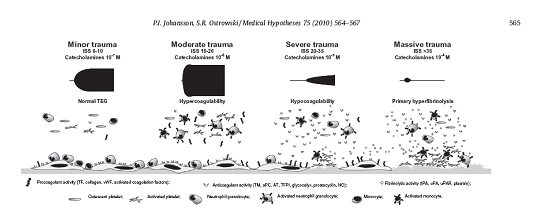
图 5 TEG图形显示了创伤程度P.I. Johansson, S.R. Ostrowski / Medical Hypotheses 75 (2010) 564–567
TEG检测的动态监测可以评估疗效,调整治疗方案,最终纠正凝血紊乱。同时能够准确预测所需血制品,便于和血库沟通。在快速TEG指导下,针对不同病人的病理学变化,实现目标导向性的个体化的输血治疗,已成为一些医疗机构复苏术中非常重要的组成部分。
丹麦医疗中心在2004年开始实施TEG指导的输血方案(见表1)。Johansson等[31]对TEG输血方案的临床应用进行了评估。研究对象为832例,24小时内红细胞的输注量大于10U的患者,其中390例为2002-2003年在传统输血方案指导下治疗的患者,442例为2005-2006年在TEG指导下输血的患者。结果表明TEG组患者30天和90天的死亡率也明显低于对照组(20% 比 31% 和22%比35%)。

Johansson PI, Vox Sang,2009; 96:111–118
表1 TEG指导的输血方案
田纳西医学院麻醉科[32]一项前瞻性研究对普通TEG和血小板图在创伤中的应用价值及其与输血和死亡率的相关性进行了评估。研究对象为161例严重创伤患者,ISS创伤评分大于9。事故现场取血做普通TEG(检测指标为R,K,MA,α角,LY60),入院后1小时检测普通TEG和血小板图。结果表明血小板图MAADP值和患者输血量相关性好,普通TEG参数和死亡率相关。事故现场和入院后TEG检测结果没有显著性差异,R值延长的患者预后不良。TEG能够早期诊断凝血障碍,指导有效的输血治疗。
Cotton[34] 等对常规凝血试验和快速TEG检测结果的相关性以及快速TEG预测输血的作用进行了评估。研究对象为272例重大创伤的患者,所有患者都进行了快速TEG和常规凝血试验(PT,INR,APTT和血小板计数)。结果表明,快速TEG的早期参数 (ACT、K值、R值)可以在运行5分钟内获得,晚期参数(α角和MA)在15分钟内获得。常规凝血试验的检测时间约为48分钟。ACT、K值、R值和PT,APTT,INR相关性强,MA和血小板计数有相关性。ACT不仅预示患者入院后1-2小时内的红细胞、血小板和血浆用量,并且可以作为一个独立指标预示哪些病人需要大量输血。当ACT值大于128秒时,患者大量输血的可能性增加5倍。
美国丹佛医学中心,利用快速TEG指导输血治疗,已经成为复苏手术的一个非常重要组成部分[35]。图6为丹佛医学快速TEG指导输血方案,这个成分输血治疗方案强调:根据R-TEG的结果,快速输入足够多的FFP,使得FFP和浓缩红细胞的比例达到1:2到1:3。对于持续性MA异常但比较稳定的患者,可以试用DDAVP(醋酸去氨加压素),因为它可以促进FVIII和vWF从细胞中释放,可以避免血小板的输注。应用目标导向的输血方案,根据快速TEG图形结果评估治疗效果,试验准确无误地步步纠正凝血功能失调。图7是根据快速TEG图形逐步纠正凝血功能障碍的实例。
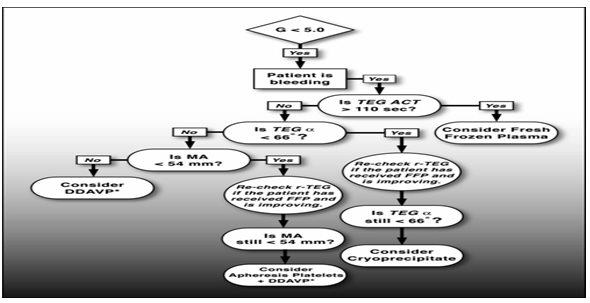
图6 丹佛医学中心快速TEG指导输血方案
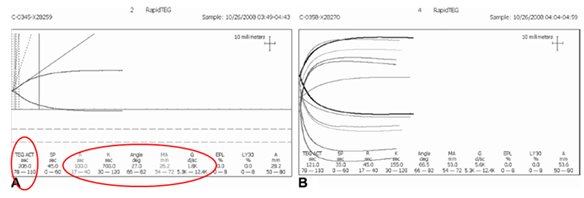
图7 TEG指导输血,纠正凝血功能障碍实例。
使用快速TEG(R-TEG),对创伤后凝血紊乱进行目标导向治疗的实例。该病例为一名遭枪击导致右肺和肝脏大出血的病人。A图,治疗前的R-TEG图形,红线标出为异常的指标;B图,根据目标导向输血方案进行治疗后,图形逐步恢复正常。
丹佛医学中心评估了快速TEG对大量输血治疗的指导意义[36]。研究对象为68例接受大量输血的患者,TEG组和对照组各34例。TEG组在图6所示输血方案指导下输血治疗;对照组在常规方法指导下治疗。分析表明,前6-12小时内FFP:红细胞比例、冷沉淀:红细胞比例、血小板:红细胞比例没有显著性差别。6小时的INR和生存率无相关性,快速TEG的G值和生存率相关性很强。MRTG(凝血酶最大产生率)大于9.2的患者接受红细胞、FFP和冷沉淀的量显著降低。
快速TEG的MA值反映血小板功能(见图8),G值反映血块力度,K和α角反映纤维蛋白原的功能,因此利用快速TEG实时监测凝血指导复苏能达到“凝血稳态”。研究表明在快速TEG指导下能够快速识别紊乱和早期纠正凝血障碍;目标导向性地进行凝血障碍的治疗,降低血制品的使用;有效改善凝血状态,提高急性出血期患者的生存率;降低炎性反应综合征(如呼吸窘迫综合症)和多器官功能不全的发病率。
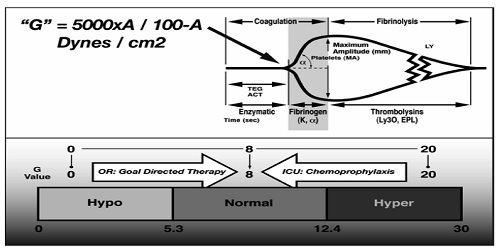
图 8 快速TEG图形。快速TEG以组织因子做激活剂,能够缩短凝血启动时间;G值衡量血凝块的强度,反映参与凝血的各种酶和血小板的共同作用的结果
TEG指导心外科手术的输血
由于凝血功能异常而导致的术后出血是心外科术后死亡率增加的主要原因,而体外循环是扰乱患者凝血功能的主要因素[37]。体外循环中抗凝剂的使用、血液稀释及低体温是导致出血倾向的三大原因。体外循环过程中,血液和机器的接触激活了凝血系统,降低了血小板的数量和功能;由于血液和晶体液的混合而稀释,不仅血细胞比容降低,凝血因子、纤维蛋白原和血小板的浓度也相应降低;另外体外循环通常采用低温来降低组织器官氧气需求量,低温也延缓了凝血过程及抑制了血小板功能[38,39]。此外,为了防止血液凝结,通常使用肝素来抗凝,虽然手术结束时用鱼精蛋白来逆转肝素的作用,但用量不足难以完全逆转肝素的作用也会导致出血。体外循环的持续时间和术后病人出血几率相关性强[40]。
由于以上原因,输血在心外科手术中极为常见,大概占整个血库血制品消耗量的20%。血制品种类的使用也很不均一,红细胞的使用率从27%至92%不等;FFP和血小板的使用率约为0%-36%[41]。
不同心外科机构对于患者输血治疗策略还未达到共识。调查表明四分之一的机构中低风险患者接受血小板输注的几率大于20%。临床医师常常根据经验使用血小板和FFP联合治疗手术后出血而不是有目的性的给予成分输血。虽然有文章倡导有目的性输血治疗[42],但大多数心外科机构还是根据患者年龄、性别、血小板抑制剂的使用和手术类型等经验性的给予输血治疗。
TEG作为床边诊断方法能全面评估凝血系统功能,有助于对患者进行个体化治疗。有证据表明,围术期结合TEG的检测结果如MA,α角的分析有助于完善传统的输血策略,节省手术患者的用血量和治疗成本[43-46]。
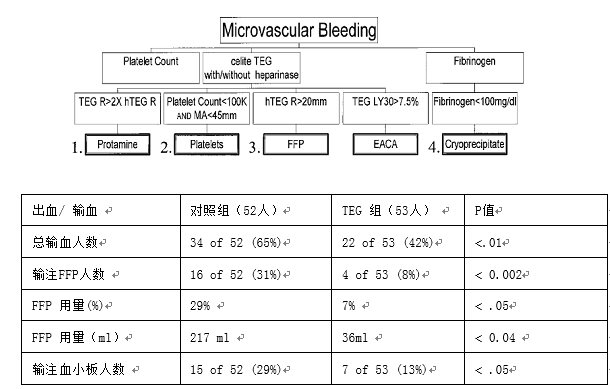
纽约西奈医疗中心[47]前瞻性研究,将心外术后输血患者随机分为两组,TEG指导输血组53例,常规凝血试验指导组52例。TEG指导组的输血方案如图9所示。1.如果鱼精蛋白中和后普通TEG的R值/肝素酶TEG R值>2,则补给50 mg鱼精蛋白。2.继续出血,血小板计数小于100000/ml, TEG MA<45mm,输注6U血小板。3.如果继续出血,R>20mm(2 mm ="1" min),,输注2U FFP。4.继续出血,纤维蛋白原小于100 mg/dL,输注10U冷沉淀。5. 继续出血, 纤溶倾向,LY30 >7.5%,给予纤溶抑制剂。研究表明:TEG指导的输血方案可以减少心外科手术患者输血量
Shore-Lesserson L, et al. Anesth Analg 1999; 88:312-9
图9 西奈医疗中心输血方案及研究结果
择期搭桥手术应用TEG输血方案,减少血液制品用量。前瞻性随机分组临床实验研究评估了TEG为指导的输血方案在选择性冠状动脉旁路移植术(CABG)中的应用价值[48]。这项研究中224例CABG患者随机分为两组,一组(110例)以常规凝血试验和医师的经验为指导进行输血治疗;另外一组(114例)以TEG参数( R值 ,MA和LY30) 指导制定输血方案(表2)。TEG 输血方案:如果“R” 延长,给予1-4 单位FFP;MA 低下,给予 1-2 单位血小板;如果LY30 高给予氨甲环酸 。结果表明,TEG组患者FFP和血小板用量显著低于对照组;TEG组抗纤溶药物氨甲环酸的使用率也明显小于对照组;TEG组患者胸腔引流液体积也低于对照组;并且TEG组术后出血探查率也低于对照组。这项研究表明以TEG为指导的输血方案简单易行,可以有效降CABG患者低血制品的消耗量,降低输血并发症的风险及降低治疗成本。

Koray Ak.etal. J Card Surg 2009;24:404-410
表 2 TEG指导输血方案-CABG手术中的应用
加拿大多伦多总医院将TEG参数加进基于年龄,性别,病史,手术和常规凝血试验等指标的风险预测模型中,评价TEG对心外科术后大出血风险的预测作用[49]。434例心外科手术的患者在体外循环前和术中分别接受了TEG检测,检测指标为R值、MA和α角。分别运用常规预测模型和附加TEG参数的预测模型对患者大出血风险进行评估。结果表明,434例患者中59例出现了大出血,其中20例被TEG模型预测为高风险占大出血人数的34%,而只有13例(22%)被常规模型预测为高风险。说明TEG参数的引入可以提高风险预测的灵敏度,显著提高大出血的预测率,有助于指导输血和个体化治疗。此外,此项研究表明术中TEG比体外循环前TEG更有预测价值,其中反映血块强度的MA值是最有意义的预测指标。
肝素被用作抑制体外循环管道与血液接触诱发的高凝状态,Gravlee等人研究表明肝素剂量浓度和失血有直接的联系。此外,肝素导致异常失血也与鱼精蛋白拮抗不充分有关。常规ACT是目前CPB过程中监测肝素抗凝的常用方法,但是受血液稀释等因素影响较大,检测结果和肝素水平相关性差。J.Chavez等[50]用TEG TF/K、Hemochron Jr. Signature® 和 Hepcon® HMS三种方法检测31例CPB患者转机前、中、后ACT值,比较三种方法测试结果之间的相关性,同时也评估了血液50%稀释后TEG和Hemochron方法检测肝素的效率。 TEG TF/K是在血样中加入足量的组织因子和高岭土以最大限度激活内外凝血途径,降低凝血因子消耗对ACT测量值的影响。为了评估血液稀释对TEG®TF/K和Hemochron ACT的影响,使用肝素(0~6U/mL)滴定稀释50%的血样本从而得到滴定曲线。此外,通过稀释50%和非稀释样本(含3.3U/mL肝素)滴定鱼精蛋白,获取TEG®TF/K和ACT中和曲线进行相比较。研究表明①TEG®TF/K ACT和Hemochron Jr. Signature® 及 a Hepcon® HMS检测结果相关性大于0.7;TEG®TF/K ACT和Hemochron方法均显示鱼精蛋白和肝素的比例1.3:1是最佳中和比例;与标准ACT检测相比,TEG®TF/K检测速度更快,检测结果受血液稀释50%影响较小,TEG®TF/K与肝素的相关性较好。TEG®TF/K ACT检测能快速监测肝素水平,评价中和水平,鉴别中和不足还是凝血功能障碍引起的出血,有利于指导临床治疗,避免不必要的输血。
中国医学科学院阜外心血管病医院评价了自2007年9月至2009年4月共31例心外科手术患儿围术期接受血栓弹力图(TEG)对围术期指导输血组和对照组的差别[51]。31例患有大动脉错位或右心室双出口伴有严重紫绀需要外科手术治疗的患儿随机分为2组,F组(17例)进行TEG指导下输血治疗,C组(14例)进行经验性的输血治疗。F组利用TEG分析凝血障碍的原因是凝血因子缺陷、纤维蛋白原不足还是血小板功能障碍。检测指标为MA,代表血小板和纤维蛋白原的交联作用,反映正在形成的血凝块的最大强度及血凝块形成的稳定性。TEG检测时间点为麻醉诱导期(T1),肝素中和后(T2)和术后4小时(T3)。TEG检测显示纤维蛋白原缺乏是导致凝血功能障碍的主要原因之一。在TEG指导下对F组患者进行成分输血治疗并以纤维蛋白原替代部分FFP的输注。数据分析显示两组患者关胸时间和术中FFP及PLT的使用量没有显著差别;在ICU的最初24小时内,两组PLT和RBC的使用量没有显著性差别,但是F组FFP的用量显著性降低;F组呼吸机使用率,ICU监护和住院时间均明显少于C组。研究结果表明,TEG有效减少了围术期血制品的使用,TEG指导下输注纤维蛋白原作为FFP的替代疗法可以改善患者预后。
自1996年起,抗血小板药物广泛用于冠心病,脑血管疾病,周围动脉阻塞性疾病预防和治疗性的降低血栓形成。其中一种抗血小板药物氯吡格雷的使用使心外科手术患者术后胸腔引流量、输血量(RBC、 FFP、PL的输注量)显著提高。研究表明,术前使用抗血小板药物的患者术后由于出血而再次手术探查的几率增高10倍。为了评估氯吡格雷对血小板的影响及与手术出血的关系,Song 等[52]的研究募集了100例每天服用阿司匹林100 mg和氯吡格雷75mg的患者,服药时间一周以上。根据停药日期将患者分为两组,每组50例,一组是术前一天停药,另一组术前3天停药。手术由同一个麻醉及医生治疗组实施,实施者不知道TEG分析结果。实施全系统肝素化(150U/KG),手术过程补充肝素维持凝血时间>300秒。手术结束时以硫酸鱼精蛋白中和肝素(0.5mg/150U肝素)。输血标准为:血细胞比容<24%时输红细胞。INR>1.5伴随连续出血>200ml/h持续2小时,补充FFP。血小板计数<50000mm3,连续出血>200ml/h持续2小时,输入血小板。麻醉前取血进行TEG血小板图检测血小板抑制率。研究表明,术后出血量与氯吡格雷对血小板的抑制率密切相关,和停药日期没有相关性;高氯吡格雷抑制率组术后失血量最大,浓缩红细胞和新鲜冰冻血浆FFP的需求量也显著高于其他组;高氯吡格雷抑制率为是否输血的独立风险因素,氯吡格雷血小板抑制率为70%时是输血的最佳临界值;输血组和未输血组常规凝血试验如血小板计数,PT,APTT 的数值没有显著性差异。因此,TEG血小板图可以预测使用血小板抑制剂患者的出血风险,有助于医师选择合适的手术时间和指导临床合理用血。
应用TEG指导输血,减少血制品消耗量[53](见图10)。Jersey Shore大学医学中心每年要实施约850例心外科手术,这些手术所用血制品量占整个中心血制品消耗量的27%,这个数值和其他医学中心的用血量相当。外科手术的患者中有相当一部分人使用氯吡格雷,外科医师假定这部分患者凝血通路受影响,经验性的给予血小板和FFP治疗。很多情况下,即使患者血红蛋白水平没有异常也接受红细胞和其他血液成分的联合治疗。其中一个曾使用TEG指导肝移植输血的麻醉师提出用TEG指导心外手术输血。用TEG可以检测到凝血过程某个特定阶段存在功能障碍,从而实现目的导向性个性化治疗,减少血小板和FFP在心外科病人中的使用量。这家医院2004年开始引入TEG,第一阶段是在心外手术室装备两台TEG,因为60%的血小板和FFP的输注是在手术室进行的。灌注师、麻醉师、心外科医师和实验人员均接受TEG质控和结果解读的培训。手术过程中,麻醉师和外科医师共同分析TEG结果,判断患者是哪个阶段存在凝血异常,从而决定所需血制品成分和数量。结果表明,使用TEG后,手术中血小板和FFP的使用量减少50%。虽然TEG不能反映血红蛋白水平,但是TEG的使用也避免了医师在成分输血时经验性的给予红细胞。TEG指导输血策略的成功推进医院进行第二阶段的TEG建设。他们在心外科重症监护病房装备了TEG,护士接受了TEG培训,测试结果会结合术后其他凝血检测的结果进行综合分析,给予患者最适合的输血治疗。第三步的TEG建设是在中心实验室装配TEG,从而使全院所用的输血治疗均可在TEG指导下进行。综上所述,TEG的使用可以实现导向性个体化输血治疗,这对于降低输血引发的并发症非常有意义。
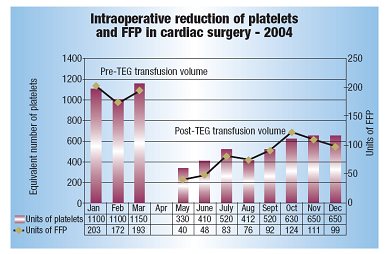
图10 TEG指导输血而减少血制品消耗量
结论
目前为止,包括4500名手术患者(多数为肝脏和心脏手术患者)和800多创伤患者的30多个临床试验比较了TEG和常规凝血试验(PT,APTT,INR)在凝血紊乱的诊断和指导成分输血中的作用。结果均表明TEG对于凝血紊乱尤其是纤溶亢进的诊断更有优势,能更好预测输血量,从而实现目标导向性治疗,减少不必要的输血和降低再次手术探查率。没有任何研究表明常规检测在预测出血和指导输血方面优于TEG。
TEG技术的应用被列入2010欧洲重大创伤的出血管理指南[54]。指南指出:INR和APTT监测凝血的启动代表小部分凝血酶产生,不能反映整体凝血系统功能障碍。当凝血系统异常时,常规检查有可能是正常的。而TEG能够提供更完整的凝血和纤溶的监测,从而更好指导成分输血。
心外科手术导致凝血状态发生很多变化,这些变化将会增加微血管的出血风险。TEG已被证明能够指导心外科手术进行围手术期的凝血管理,前瞻性评估出血风险,及时发现问题并提示解决方案(见表3)。
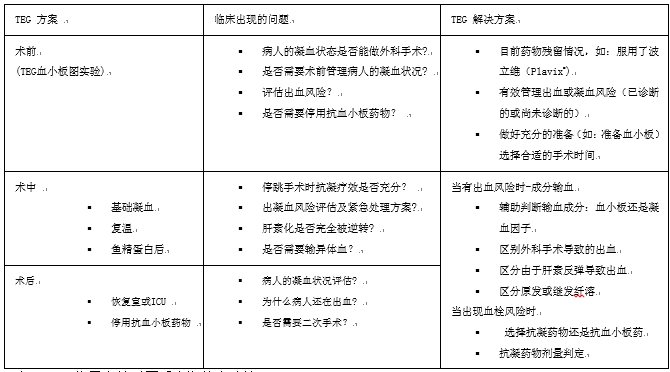
表 3 TEG指导心外科围手术期的血液管理
TEG能够反映心外科手术病人凝血功能紊乱,检测结果与出血量及输血量相关性好,对临床治疗起到有效的监测和一定的指导作用。2008年,TEG被列入年欧洲心胸外科抗血小板及抗栓治疗的管理指南中[55](见图11)
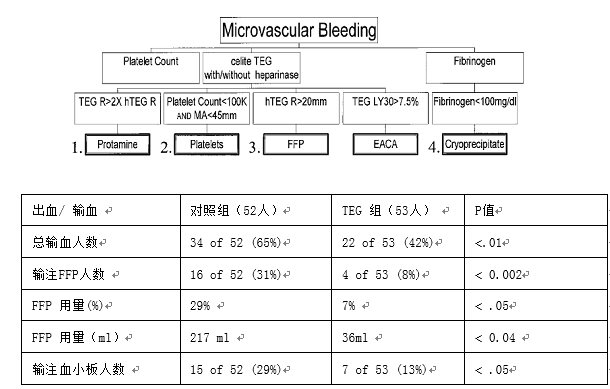
图11. 欧洲心胸外科抗血小板及抗栓治疗的管理指南,TEG指导输血及血制品的使用
凝血效率由凝血因子,血小板和内皮及无数蛋白共同作用的结果。即使像TEG这样较完善的检测手段也难以完全反映体内整体凝血状态。需要结合患者的临床表现和其他检测手段综合考虑治疗方案。
参考文献
1. Brown, M., and Whalen, P.: “Red Blood Cell Transfusion in Critically Ill Patients: Emerging Risks and Alternatives,” Critical Care Nurse, Supp. December 2000.
2. Pohlman, A., Carven, J., and Lindsay, K.: “Conserving Blood in the IntensiveCare Unit,” Critical Care Nurse, Supp.December 2001.13. Spiess, B.: “Blood Transfusion: The Silent Epidemic,” Annals of Thoracic Surgery. 72:S1832-1837, 2001.
3. Kokkini, G.: “Transfusion-Related Acute Lung Injury,” Transfusion Alternatives in Transfusion Medicine. 4(2):58-61, 2002.
4. Murray D, Pennell B, Olson J. Variability of prothrombin time and activated
partial thromboplastin time in the diagnosis of increased surgical bleeding. Transfusion 1999; 39:56–62.
5. Segal JB, Dzik WH. Transfusion medicine hemostasis clinical trials network. Paucity of studies to support that abnormal coagulation test results predict bleeding in the setting of invasive procedures: an evidence-based review. Transfusion 2005; 45:1413–1425.
6. Counts RB, Haisch C, Maxwell NG, et al. Hemostasis in massively transfused patients. Ann Surg. 1979;190:91–99.
7. Lucas LE, Ledgerwood AM. Clinical significance of altered coagulation tests after massive transfusion. Ann Surg. 1981;47:125–130.
8. Sorensen B, Ingerslev J. Whole blood clot formation phenotypes in hemophilia A and rare coagulation disorders.Patterns of response to recombinant factor VIIa. J Thromb Haemost 2004;2:102-10.
9.Schochl H, Nienaber U, Hofer G, et al. Goal-directed coagulation management of major trauma patients usingthromboelastometry (ROTEM)–guided administration of fibrinogen concentrate and prothrombin complex concentrate. Crit Care 2010;14:R55.
10. Chavez JJ, Foley DE, Snider CC, et al. A novel thrombelastograph tissue factor/kaolin assay of activated clotting times for monitoring heparin anticoagulation during cardiopulmonary bypass. Anesth Analg 2004;99: 1290-4.
11. Noval-Padillo JA, Leon-Justel A, Mellado-Miras P, et al. Introduction of fibrinogen in the treatment of hemostatic disorders during orthotopic liver transplantation: implications in the use of allogenic blood. Transplant Proc 2010;42:2973-4.
12.Hartert H. Blutgerinnungsstudien mit der thromboelastographie,einem neuen Untersuchungsverfahren. Klin Wochenschrift 1948;26:557-83.
13. Katori N, Tanaka KA, Szlam F, Levy JH. The effects of platelet count on clot retraction and tissue plasminogen activator-induced fibrinolysis on thrombelastography. Anesth Analg 2005;100:1781-5.
14. Kjalke M, Monroe DM, Hoffman M, Oliver JA, Ezban M, Roberts HR. Active site-inactivated factors VIIa, Xa, and IXa inhibit individual steps in a cell-based model of tissue factor-initiated coagulation.Thromb Haemost. 1998;80:578 –584.
15. Hoffman M, Monroe DM. A cell based model of hemostasis. Thromb Haemost. 2001;85:958 –965.
16. Monroe DM, Roberts HR, Hoffman M. Platelet procoagulant complex assembly in a tissue factor-initiated system. Br J Haematol. 1994;88:364 –371.
17. Monroe DM, Hoffman M, Roberts HR. Transmission of a procoagulant signal from tissue factor-bearing cell to platelets. Blood Coagul Fibrinolysis. 1996;7:459 – 464.
18. Butenas S, Brummel KE, Branda RF, Paradis SG, Mann KG. Mechanism of factor VIIa-dependent coagulation in hemophilia blood. Blood. 2002;99:923–930.
19. Platelets and Thrombin Generation, Dougald M. Monroe, Maureane Hoffman and Harold R. Roberts, Arterioscler Thromb Vasc Biol 2002, 22:1381-1389:
20. Monkovic DD, Tracy PB. Activation of human factor V by factor Xa and thrombin. Biochemistry. 1990;29:1118 –1128.
21. Monroe DM, Hoffman M, Roberts HR. Transmission of a procoagulant signal from tissue factor-bearing cell to platelets. Blood Coagul Fibrinolysis. 1996;7:459 – 464.
22. Tracy PB, Rohrbach MS, Mann KG. Functional prothrombinase complex assembly on isolated monocytes and lymphocytes. J Biol Chem. 1983;258:7264 –7267.
23.Roberts HR, Hoffman M, Monroe DM. A cell-based model of thrombin generation. Semin Thromb Hemostat 2006; 32:32–38.
24.Sauaia A, Moore FA, Moore EE, et al. Epidemiology of trauma deaths: a reassessment. J Trauma. 1995;38:185–193.
25. Kashuk JL, Moore EE. Thromboelastography: goal-directed management of postinjury coagulopathy. Pan American J Trauma. In press
26. Kashuk J, Moore EE, Le T, et al. Non Citrated whole blood is optimal for evaluation of postinjury coagulopathy with point of care rapid thromboelastography. J Surg Res. 2009;156:133–138.
27. Kaufman J, Christoph R, Dwyer K, et al. Usefulness of thrombelastography in assessment of trauma patient coagulation. J Trauma. 1997;42:716 –722.
28. Schrieber MA. Coagulopathy in the trauma patient. Curr Opin Crit Care. 2005;11:590 –597.
29. Rugeri L, Leuvat A, Delecroix E. Diagnosis of early coagulation abnormalities
in trauma patients by rotational thromboelastography. J Thromb Haemost. 2006;5:289 –295.
30. Johansson PI, S.R. Ostrowski.Acute coagulopathy of trauma: Balancing progressive catecholamine induced endothelial activation and damage by fluid phase anticoagulation.P.I. Medical Hypotheses 75 (2010) 564–567
31. Stensballe J. Effect of haemostatic control resuscitation on mortality in massively bleeding patients: a before and after study. Vox Sang 2009; 96:111–118.
32 ROGER C .etal.Early evaluation of acute traumatic coagulopathy by thrombelastography . Translational Research 2009;154:34–39)
33. Jeger V, Zimmermann H, Exadaktylos AK. Can Rapid TEG accelerate the search for coagulopathies in the patient with multiple injuries?J Trauma. 2009;66:1253–1257.
34. Bryan A. Cotton,etal.Rapid Thrombelastography Delivers Real-Time Results That Predict Transfusion Within 1 Hour of Admission.J Trauma. 2011;71: 407–417
35. Jeffry L. Kashuk,etal .Postinjury Coagulopathy Management
Goal Directed Resuscitation via POC Thrombelastography.Ann Surg 2010;251: 604–614
36. Jeffry L. Kashuk,etal Initial experiences with point-of-care rapid thrombelastography
for management of life-threatening postinjury coagulopathy.TRANSFUSION.2011 Jul 25. [Epub ahead of print]
37. Spiess, B., and Tuman, K., et al.Thromboelastography as an Indicator Post-Cardiopulmonary Bypass Coagulopathies.Journal of Clinical Monitoring. 3(1):25-30, 1987.
38. Despotis, C., et al.Factors Associated with Excessive Postoperative Blood Loss and Hemostatic Transfusion Requirements: A Multivariate Analysis in Cardiac Surgical Patients.Anesthesia and Analgesia. 82:13-21, 1996.
39. Kettner, S.Effects of Hypothermia on Thrombelastography in Patients Undergoing Cardiopulmonary Bypass.British Journal of Anaesthesia. 80:313-317, 1998.
40. Hardy, J., et al.The Stratification of Cardiac Surgical Procedures according to Use of Blood Products: A Retrospective Analysis of 1,480 Cases, Canadian Journal of Anaesthesia, 38(4):511-517, 1991.
41. Stover, E., et al.Variability in Transfusion Practice for Coronary Artery BypassSurgery Persists despite National Consensus Guidelines: A 24-Institution Study,Institutions of the Multicenter Study of Perioperative Ischemia Research Group. Anesthesiology. 88:327-333, 1998.
42. Shore-Lesserson, L., et al.Thromboelastography-Guided Transfusion Algorithm Reduces Transfusion in Complex Cardiac Surgery,” Anesthesia and Analgesia. 88:312-9, 1999.
43. Shore-Lesserson L, Manspeizer HE, DePerio M, et alThromboelastography-guided transfusion algorithm reduces transfusions in complex cardiac surgery. Anesth Analg 1999;88:312-319.
44. Royston D, von Kier S: Reduced haemostatic factor transfusion using heparinase-modified thromboelastography during cardiopulmonary bypass. Br J Anaesth
2001;86:575-578.
45. Ronald A, Dunning J: Can the use of thromboelastography predict and decrease bleeding and blood and blood product requirements in adult patients undergoing cardiac surgery? Interact Cardiovasc Thorac Surg 2005;4:456-463.
46. Spalding GJ, Hartrumpf M, Sierig T, et al: Cost reduction of perioperative coagulation management in cardiac surgery: Value of “bedside” thromboelastography
(ROTEM). Eur J Cardiothorac Surg 2007;31:1052-1057.
47. Linda Shore-Lesserson etal.Thromboelastography-Guided Transfusion Algorithm Reduces Transfusions in Complex Cardiac Surgery.Anesth Analg 1999;88:312–9
48.Thromboelastography-based transfusion algorithm reduces blood product use after elective CABG: a prospective randomized study. J Card Surg. 2009 Jul-Aug;24(4):404-10.
49. Marcin Wasowicz etal.The Incremental Value of Thrombelastography for Prediction of Excessive Blood Loss After Cardiac Surgery: An Observational Study. ANESTHESIA & ANALGESIA August 2010 • Volume 111 • Number 2
50. Jack J. Chavez, etal.A Novel Thrombelastograph® Tissue Factor/Kaolin Assay of Activated Clotting Times for Monitoring Heparin Anticoagulation During Cardiopulmonary Bypass. Anesth Analg 2004;99:1290–4)
51.Yongli Cui etal. Perioperative Monitoring of Thromboelastograph on Blood Protection and Recovery for Severely Cyanotic Patients Undergoing Complex Cardiac Surgery.Artificial Organs 34(11):955–960
52.song etal.Clopidogrel Responsiveness Regardless of the Discontinuation Date Predicts Artery Bypass Graft Surgery Increased Blood Loss and Transfusion Requirement After Off-Pump Coronary.J. Am. Coll. Cardiol. 2010;56;1994-2002
53. Thromboelastography-Based Transfusion Algorithm Reduces. May 2005 Nursing Management 29
54.Management of bleeding following major trauma: an updated European guideline. Critical Care 2010,14: R52
55. European Journal of Cardio-thoracic Surgery 34(2008) 73-92

澳门新葡游戏网APP
快速挂号